On constate un paradoxe : l’organisme possède plusieurs milliards de spécificités immunitaires capables de produire plusieurs milliards de clones de lymphocytes B et T qui diffèrent par la nature de leurs récepteurs membranaires. Or ces récepteurs sont des protéines codées par des gènes et il y en a donc des milliards, alors que le génome humain ne compte environ que 25 000 gènes.
En fait, il n’existe que quelques gènes contrôlant la production des anticorps et des récepteurs T. Par des mécanismes d’épissage de l’ARN pré-messager et de réarrangements de fragments géniques, on peut obtenir un nombre infini de lymphocytes monoclonaux.
Le problème de ces réassociations géniques au hasard est que les récepteurs membranaires sont capables de reconnaître n’importe quel antigène du soi ou du non soi. S’ils reconnaissent du soi, les cellules immunitaires d’un organisme se retournent contre les cellules de celui-ci ce qui est à l’origine des maladies auto-immunes. Il faut donc que l’organisme conserve les cellules immunocompétentes capables de reconnaître du non soi (et qui constitueront le répertoire immunitaire) et élimine les cellules auto réactives capables de reconnaître du soi, c’est ce que l’on appelle la tolérance.
Lorsque les mécanismes de tolérance ne suppriment pas ou plus les lymphocytes auto-réactifs, il y a ce qu’on appelle une rupture de tolérance, à l’origine d’une maladie auto-immune (MAI).
Les mécanismes de tolérance peuvent être divisés en deux parties : la tolérance centrale et la tolérance périphérique. Nous allons maintenant vous présenter ces phénomènes.
La tolérance centrale
La différenciation des progéniteurs des lymphocytes T dépend des réarrangements des gènes codant pour les récepteurs d’antigènes, et de l’expression des marqueurs membranaires (cf. 3. Choix de cluster de différenciation). Pour les LT (Lymphocytes T), cela se déroule au niveau du thymus. Les thymocytes sortent de la moelle osseuse et rejoignent le thymus par la circulation sanguine.
Les thymocytes (lymphocytes immatures) se différencient selon plusieurs voies et donnent ainsi plusieurs sous-catégories de LT, fonctionnellement différents (LTCD8, LTCD4). À la sortie du thymus, des LT matures dits naïfs sont obtenus.
Lors du développement dans le thymus, les thymocytes subissent des modifications phénotypiques. Ils passent, en fonction de la maturation de leur TCR, par plusieurs étapes de sélection durant lesquelles ils reçoivent des signaux, leur permettant ou non d’accéder à l’étape suivante. Le but de cette sélection est de sélectionner les thymocytes possédant un TCR fonctionnel qui n’induira pas de réactions auto-immunes.
Lors de l’entrée dans le thymus, les thymocytes sont au premier stade, le stade « double négatif » car ils ne présentent ni CD4, ni CD8, ni CD3 et ni TCR.
1. Choix du lignage :
La première étape est le choix du lignage. Lors de cette étape des réarrangements géniques vont avoir lieu afin de déterminer le type de TCR que présenteront les thymocytes. Le type de TCR détermine la lignée de la cellule : soit en LT-αβ, soit en LT-γδ ou soit en cellule NKT.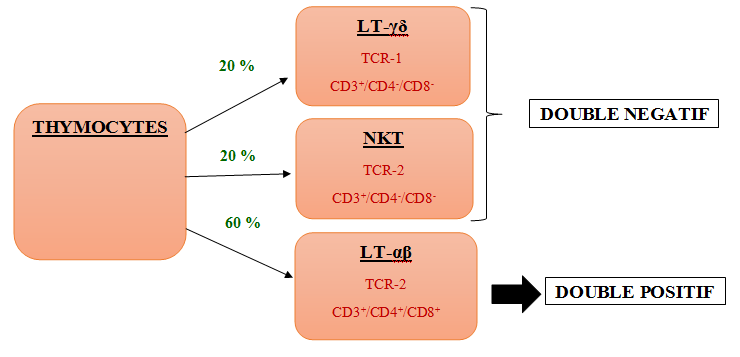
Seuls les thymocytes de la lignée des LT-αβ continueront la différenciation, soit 60% des thymocytes, car seuls eux pourront se différencier en doubles positifs.
Dans un premier temps, les thymocytes expriment un TCR incomplet, on parle de pré-TCR, car ils présentent une chaîne β complète associée à une chaîne α dite pré-T α. Cette chaîne pré-T α se différencie de la chaîne α par l’absence de domaines variables. Elle est donc identique pour tous les thymocytes.
Dès cette première étape, la chaîne β subit un réarrangement génique. Si celui-ci est productif, c’est-à-dire si la chaîne β est capable de reconnaître des peptides du CMH, le thymocyte reçoit un signal de survie, grâce à l’expression du CD3. Si le réarrangement n’est pas productif, un nouveau réarrangement aura lieu jusqu’à en obtenir un productif.
Après multiplication, les thymocytes passent au stade « double positif », c’est-à-dire qu’ils expriment à la fois le CD4 et le CD8. Au cours de cette étape, la chaîne α (la partie variable) subit à son tour un réarrangement génique. Les thymocytes présentent ainsi un TCR α-β complet associé au CD3, au CD4 et au CD8.
Les thymocytes formés possèdent des TCR capables de reconnaître n’importe quel peptide (du soi ou du non-soi) présenté par n’importe quel CMH (du soi ou du non-soi). Des sélections doivent donc être mises en place afin de sélectionner uniquement les thymocytes capables de reconnaître à la fois les peptides du non-soi et les CMH du soi.
2. Sélection positive :
Les lymphocytes T doubles positifs (exprimant à la fois les co-récepteurs CD4+ et CD8+) migrent vers le cortex thymique. Dès lors, le TCR des thymocytes (et respectivement les molécules CD4 et CD8) va entrer en interaction avec les cellules épithéliales qui expriment à leur surface les molécules du CMH présentant des antigènes peptidiques.

Schéma du Thymus (Source image : www.jle.com)
Pour ce faire les thymocytes se déplacent le long de fibres constituées par le stroma thymique favorisant les interactions cellulaires. Les LT reconnaissent alors des déterminants séquentiels sous forme de peptides de 8-30 acides aminés insérés dans les molécules du CMH. Les contacts avec le CMH des cellules épithéliales corticales peuvent être de deux natures : stables et de longue durée, ou transitoires en série (à l’heure actuelle il n’a pas été identifié s’il y avait une différence fonctionnelle ou chronologique entre ces deux types d’interaction).
Parmi les précurseurs venant de la moelle osseuse, sont sélectionnés ceux dont le réarrangement aléatoire des gènes codant pour le récepteur T génère un domaine variable capable d’interagir avec les molécules du CMH. L’avidité du TCR pour le complexe CMH-antigène détermine si le thymocyte recevra ou non le signal de survie:
- S’il reconnait le complexe CMH-peptide du soi avec suffisamment d’affinité, le LT reçoit le signal de survie.
- S’il répond mais se lie trop fortement aux molécules du CMH : il est alors considéré comme délétère pour le soi
- S’il ne reconnait pas les molécules du CMH de classe I ni II (plus de 95% d’entre eux), le LT ne reçoit pas de signal de survie.
Cette sélection permet de s’assurer que seuls les thymocytes fonctionnels et non susceptibles d’induire des phénomènes d’auto-immunité en périphérie seront conservés. Elle est dite « positive » car les cellules survivantes sont celles qui ont lié une interaction, et est donc nécessaire pour induire une réponse immunitaire restreinte aux molécules du CMH du soi. Ce système reste néanmoins très coûteux en énergie : 90% des thymocytes n’auront pas d’affinité suffisante pour les complexes CMH-peptides et seront détruits car incapables de recevoir les signaux de survie transmis lors d’une interaction de bonne affinité. Ils meurent par apoptose en trois ou quatre jours dans le thymus, les débris étant éliminés par les macrophages. La sélection positive permet également la différenciation des LT CD4+ et CD8+ que nous décrirons par la suite.
3. Choix de cluster de différenciation :
Selon la nature du CMH que leur TCR a pu lier, les thymocytes « doubles positifs » se départisent d’un des clusters de différenciation afin de n’en exprimer plus qu’un seul et passer ainsi au stade « simple positif ».
Si le TCR interagit avec une molécule du CMH de classe I, il diminuera l’expression du CD4 et augmentera celle du CD8, en revanche l’inverse se produira s’il reconnaît une molécule du CMH de classe II. Toutes les cellules présentent à leur surface membranaire un CMH de classe I alors que seules les CPA (cellules présentatrices d’antigène) présentent un CMH de classe II.
Les LT exprimant le marqueur CD4 deviendront des LT auxiliaires (helper) sécréteurs de cytokine, tandis que les marqueurs CD8 conduiront à des LT cytotoxiques. De ce fait, la sélection positive détermine le potentiel fonctionnel des thymocytes matures par le choix du co-récepteur approprié.
Les thymocytes positivement sélectionnés se dirigent ensuite vers la médulla (moelle thymique) à travers la jonction cortico-médullaire au niveau de laquelle les veinules à endothélium haut (HEV) ainsi que le récepteur S1P1 (Sphingosine 1 Phosphate, sécrété par les péricytes) réguleront la sortie des thymocytes matures. Parmi eux, environ 10% sont de simples positifs CD4+ et environ 5% sont simples positifs CD8+, sur des millions de thymocytes générés.
4. Sélection négative :
Ce processus permet l’élimination précoce des LT et LB (lymphocytes B) auto-réactifs (les LB nécessitent l’assistance des LT auxiliaires pour réagir avec l’antigène), qui, une fois situés en périphérie, seraient dangereux pour l’organisme. Sa prévention, notamment contre les maladies auto-immunes, fait de lui le mécanisme principal de la tolérance immunitaire.
Contrairement à la sélection positive, cette seconde sélection peut être médiée par de nombreux types cellulaires tels que les macrophages et les cellules dendritiques qui captent les antigènes exprimés par les cellules épithéliales médullaires. Toutes présentent des peptides du soi exprimés par la protéine AIRE (AutoImmune REgulator) indispensable à l’expression ectopique d’antigènes tissulaires (comme l’insuline), qui possède de fortes similitudes avec des facteurs de transcription.
Ces cellules présentatrices d’auto-antigènes vont rencontrer les LT activés donnant lieu à une nouvelle interaction entre les molécules du CMH et le TCR des thymocytes :
- Si les cellules reçoivent un signal trop intense via le thymocyte, ce dernier sera mis hors de nuisance : par son inactivation fonctionnelle (ou anergie) s’il s’agit d’une cellule épithéliale, ou bien éliminé par apoptose s’il s’agit d’une cellule dendritique.
- Si le TCR n’interagit pas avec le complexe CMH-peptide du soi, le thymocyte pourra être conservé.

Schéma bilan des sélections thymiques (Source image : cours université de médecine de Montpellier)
Lorsque les LT naïfs quittent le thymus, ils sont incapables de réagir à la présence de leur propre peptide et sont alors qualifiés d’immunocompétents. De petite taille et en état de repos, ils se dirigent vers la périphérie via les vaisseaux de la jonction cortico-médullaire. Les LT peuvent à présent circuler dans le sang et les organes lymphoïdes secondaires, ne revenant jamais dans le thymus (car ce-dernier ne possède pas de circulation lymphatique).
Finalement, seulement 2% des thymocytes générés seront sélectionnés et rejoindront le système immun périphérique.
Voici ci-dessous un schéma bilan récapitulant la sélection positive et négative :

Schéma bilan des sélections positives et négatives (Source image : acces.ens-lyon.fr)
La tolérance périphérique
Elle met en commun tous les mécanismes permettant la destruction ou l’inactivation des LT auto-réactifs dans les organes lymphoïdes secondaires, c’est-à-dire ceux qui n’ont pas été éliminés par les mécanismes de Tolérance centrale.
1. Le rôle de la costimulation :
En plus de la reconnaissance antigène/LT par la formation du complexe CMH/TCR, il existe des signaux de costimulation qui vont être responsables du devenir du lymphocyte. Le LT présente à sa surface une molécule de costimulation CD28 qui peut se coupler avec une molécule de type CD80 ou CD86 présente sur la surface de la cellule présentatrice d’antigène (APC). Lorsque ce couplage a lieu, cela entraîne la production d’interleukine-2, ce qui engendre la prolifération du type de LT en question. Au contraire, en l’absence du signal CD80/86 sur l’APC, l’antigène sera reconnu comme molécule du soi et cela entraînera la suppression de la fonction immunitaire du LT. Ce lymphocyte sera donc inactif immunitairement : c’est ce que l’on appelle l’Anergie clonale.
De plus, le lymphocyte T peut également présenter à sa surface une molécule de type CTLA-4 qui peut se coupler avec le signal CD80/86 avec plus d’affinité que la molécule CD28. Lorsque le couplage CTLA-4/CD80 (ou 86) a lieu, cela conduit à l’inhibition de la production interleukine-2 et donc à l’inhibition du LT (qui ne sera pas actif).

Schéma bilan de la costimulation (Source image : Moreau – Cours sur la Tolérance immunitaire – CHU de Pellegrin)
2. Le rôle des LT régulateurs :
a) Caractéristiques des LT régulateurs :
Les lymphocytes T régulateurs constituent une sous-population de lymphocytes TCD4 présentant une forte expression du marqueur CD25 (chaîne alpha du récepteur à l’interleukine 2) ainsi que du facteur de transcription appelé FoxP3+. Ils furent mis en évidence en 1995 chez la souris et en 2001 chez l’Homme.
Des mutations génétiques sur le gène FoxP3, responsables de la perte de sa fonction, entraînent le développement de réactions auto-immunes graves chez la souris et d’un syndrome IPEX (Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked) chez l’Homme, caractérisé par des atteintes polyendocriniennes et des allergies alimentaires multiples. Cela met en évidence le rôle des Treg dans les mécanismes de tolérance.
Il existe des lymphocytes T régulateurs naturels (nTreg) et des lymphocytes T régulateurs induits (iTreg). Les nTreg sont produits par le Thymus et jouent un rôle important dans le contrôle de l’auto-immunité et dans la mise en place de la tolérance foeto-maternelle. Tandis que les iTreg sont produits en périphérie et ont pour rôle de contrôler les LT naïfs autoréactifs n’ayant pas été supprimés dans le thymus. Ces derniers présentent une sous-catégorie, les lymphocytes Tr-1, qui expriment les marqueurs CD4, CD25 mais pas FoxP3.
b) Mécanismes d’action :
Les Treg agissent en inhibant la fonction effectrice des Lymphocytes T réactifs qui stimulent la réponse auto-immune. Le développement de la fonction régulatrice des Treg nécessite l’expression du gène FoxP3.
Les Treg utilisent différents mécanismes pour réaliser cela et certains ne sont pas encore bien connus. Parmi ces mécanismes nous pouvons citer la production de cytokines immunosuppressives (qui inhibent la réponse des lymphocytes effecteurs) telles que l’interleukine 10 (produites par les TR-1), l’interleukine 35 ou la TGF-β (produites par les iTreg et nTreg).
De plus, les lymphocytes T régulateurs ayant une affinité très importante avec l’interleukine 2, ils sembleraient également réguler la fonction des LT effecteurs en réduisant la concentration d’interleukine 2 (en la consommant), celle-ci étant responsable de la prolifération des autres Lymphocytes.
Il semblerait de plus, que les nTreg puissent supprimer directement les lymphocytes T cibles, par un contact cellulaire direct (mais ce mécanisme reste encore flou).
Enfin, il semblerait que d’autres populations lymphocytaires (cellules TCD4-/CD8-, TCD8+, Tgamma/delta, NKT ou encore certains lymphocytes B) aient une potentiel régulateur et joueraient donc aussi un rôle dans le maintien de la tolérance périphérique.
Date de publication de l’article: 2 mai 2016
Dernière mise à jour: 11 mai 2016